名古屋女子大学に勤務し始めた頃(2008年)、同僚の先生から「ビタミンCは補酵素か」との質問を受けたことがあって、そのとき、「ドーパミンβ-水酸化酵素の場合は補酵素とするのが適切」と返答した記憶があります。アスコルビン酸は基質と化学量論的に反応するので、NADHやNADPH を補酵素とする酵素と同様に考えることができるというのが、そのときの判断の根拠でした。最近ビタミンC 研究委員会(https://vc-research.info/)で、そのホームページに「やさしいビタミンCの知識」を載せる企画が始まって、私もビタミンCと酵素に関する3つの記事を投稿しました。そのなかの一つ(https://vc-research.info/wisdom/w_09.html)で、「アドレナリンができる1段階前の反応は、ドーパミンからノルアドレナリン(ノルエピネフリンとも呼ばれる)への変換です。この反応でビタミンCが水酸化酵素(ドーパミンβ-ヒドロキシラーゼ)の補酵素として働きます。」と記載しました。委員会の小城勝相先生から、「普通は電子を与えるだけで他の還元剤でも代役が可能な場合は補因子になるようです。補酵素B群のように酵素が認識部位をもっていて特異的に結合しているという必要があるのでしょうか。」と、私の「ビタミンC補酵素説」への問題提起があり、先生と数回やり取りをするなかで文献をいろいろ調べて勉強しました。
ドーパミンβ-水酸化酵素をインターネット検索してみると、ほとんどがアスコルビン酸を補因子とし、補酵素とするものは稀でした。さらに、たいていの生化学の教科書では、アスコルビン酸が補酵素か否かについて言及していません。この現状を鑑みて、学習者を混乱させないようにウェブ上の記事で「この反応でビタミンCが水酸化酵素(ドーパミンβ-ヒドロキシラーゼ)の基質の一つとして作用します。」と修正しました。そこでこの機会に、手持ちの書物を調べて「補酵素とは何か」という問いに答えつつ、「ビタミンC補酵素説」の妥当性を考察してみました。
まず、「補酵素とは何か」の問いから始めましょう。酵素の研究が生化学の中心的課題であった頃に、Enzymesというタイトルの、研究者にとってバイブル的な存在であった本があります。手元の3版(M. Dixon & E.C. Webb著、Longman、1964)のEnzyme Cofactorsの章に、補因子(cofactor)を作用様式によって分類した、(a)As inter-enzyme carriers、(b) As a prosthetic
group など8つのタイプが記載されています。ちなみに、補因子は酵素たんぱく質以外の、酵素活性発現に必要な物質を広く指します。(a)と(b)の説明は下記のようです。
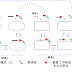
(a)のinter-enzyme carriers(酵素間で働く移送体)は、酵素1と結合して基質分子の一部を受けとる。そして、受け取った部分を担った移送体は別の酵素2に届ける。その移送されてきた部分が酵素2の基質分子に受け渡され、そのあと移送体が酵素から遊離する。移送体は、二つの酵素からなるシステムの補因子として働くが、各酵素の第二の基質として別々に作用する(図1)。
(b)のprosthetic group(補欠分子族)は、酵素の反応に必要不可欠な化学物質で、一般的に酵素タンパク質と強固に結合する。結合のモル比は通常1:1。補欠分子族は、基質分子(供与体)の一部を取り除いて、同一酵素のもう一つの基質(受容体)に転移させる(図2)。いわば、分子内移送体である。補欠分子族は、同一の酵素に結合したままで働く点が、(a)タイプの移送体(2つの異なる酵素間を行き来する)と異なる。
 |
①基質と移送体の結合
②基質の赤丸部分の移送体への転移
③生成物と移送体の遊離
 |
| このタイプの移送体は酵素たんぱく質に強く結合していて、透析によって遊離しない。共有結合している場合もある。いずれの場合も補欠分子族と呼ばれる。 |
Enzymesの1章では、補酵素(coenzyme)は作用様式(a)で働く物質であると示されています。また、A. Whiteらの教科書Principles of Biochemistry
6th Ed., McGraw-Hill, 1978では、作用様式(a)の移送体だけを補酵素とし、(b)の補欠分子族と区別しています。「有機化合物の補因子には、基質から除かれた原子ないし官能基を受け取ったり、原子ないし官能基を担って基質に付加したりするものがある。このような補因子は補酵素と呼ばれ、酵素から容易に解離する。基質と化学量論的に反応するので、補助基質(co-substrate)と見なすのが適切である。」という趣旨のことが書いてあります。最近の生化学の教科書でもR.K. MurrayらのHarper‘s
Illustrated Biochemistry 27th Ed., 2006やD. Voet & J.G. VoetのBiochemistry
, John Wiley and Sons, 1995のように、補酵素を補欠分子族と区別して説明しているものがあります。
しかし今日では、Enzymesに記載された作用様式(a)または(b)で働く有機分子を合わせて補酵素であるとするのが一般的です。E. BaldwinのDynamic Aspects of Biochemistry 3rd Ed., Cambridge University Press,
1957 では、基本的には上記のように補酵素と補欠分子族を説明をしたうえで、それぞれの機能が明確であれば、両者の違いは大事なことではないと記しています。A.L. Lehninger のBiochemistry 2nd Ed., Worth
Publishers, 1975では、「非タンパク質性の補因子が必要な酵素があり、有機化合物の補因子が補酵素である。・・・・補酵素は通常、酵素反応で移送される官能基、特定の原子あるいは電子の中間移送体として働く。」と述べています。また、D.E. Metzler のBiochemistry, Academic Press, 1977にはCoenzymesの章があって、「多くの場合、補酵素は化学基、水素原子ないし電子を受け取ったり受け渡したりする触媒である」と説明し、3グループに分けています。それらは、化学基の供与体となる補酵素(ATP, GTPなど)、化学基の転移を容易にする補酵素(ピリドキサルリン酸、チアミンニリン酸など)および酸化還元に係る補酵素(NAD、 FADなど)です。
ここで、補酵素がEnzymesに記載された作用様式(a)または(b)で働く有機分子であるとする立場で、補酵素の属性をまとめると次のようになります。
① 化学基、水素原子ないし電子の移送をする機能を持つ有機化合物である。
② 酵素のタンパク質部分との結合は、共有結合から一時的な結合まで程度が様々である。
③ 結合の強い場合の補欠分子族では、上記の移送が酵素分子内で起きるので自ずから触媒的に働く。
④ 結合の弱い場合、補助基質(co-substrate)として基質と化学量論的に反応する。その生成物は酵素から遊離して別の反応でリサイクルされて触媒的に働く。
Enzymesにある作用様式(a)について、エネルギー代謝にかかわる酵素のなかから、いくつか具体例を挙げてみます。
1) グリセルアルデヒド-3-リン酸脱水素酵素
NAD+がアポ酵素に結合してホロ酵素が形成されたのち、基質グリセルアルデヒド-3-リン酸(GAP)が結合し、基質からNAD+へのヒドリド(H:)の転移によってNADHが生成する。最後に無機リン酸(Pi)が基質の1位に結合し、1,3-ビスホスホグリセリン酸(1,3BPG)が生成する。
NAD+ + GAP + Pi ←→ NADH + 1,3BPG + H+ (1)
2) 乳酸脱水素酵素
NAD+がアポ酵素に結合してホロ酵素が形成されたのち、基質の乳酸が結合し、乳酸からのヒドリド(H:)の転移によってNADH ができ、ピルビン酸が生成する。
NAD+ + CH3CH(OH)COO- ←→ NADH + CH3COCOO- + H+ (2)
3) コハク酸-ユビキノンオキシドレダクターゼ
ミトコンドリア電子伝達系の複合体IIとも呼ばれ、コハク酸からユビキノン(U、酸化型コエンザイムQ)に電子を移す。コハク酸はフマル酸に酸化され、ユビキノンはユビキノール(UH2)に還元される。補欠分子族としてFADと3種類の鉄イオウクラスターおよびシトクロムbを持つ。
コハク酸 + U ←→ フマル酸 + UH2 (3)
4) ユビキノール-シトクロムcオキシドレダクターゼ
ミトコンドリア電子伝達系の複合体IIIとも呼ばれ、ユビキノール(還元型コエンザイムQ)からシトクロムc(Cyt c)に電子を移す。反応の結果ユビキノールはユビキノンになる。鉄イオウクラスター1個、シトクロムb2個、シトクロムc11個を補欠分子族として有する。
UH2 + 2 酸化型Cyt c ←→ U + 2 還元型Cyt c + 2 H+ (4)
1)と2)は解糖系の反応で、嫌気的条件では、1)で生成するNADHが2)の逆反応によってNAD+に再生される。また、3)と4)はミトコンドリアの電子伝達系の反応で、3)で生成するユビキノールが4)の反応によってユビキノンに再生。(a)の作用様式に照らして考えると、NAD+とNADHおよびユビキノンとユビキノールが補酵素です。
いよいよ、本論の「アスコルビン酸は補酵素か」の問題に入ります。冒頭で述べた「ドーパミンβ-水酸化酵素の場合は補酵素とするのが適切」と考える根拠を述べましょう。この酵素は一酸素添加酵素の一つです。一酸素添加酵素は、触媒部位に酸化還元サイクルが可能な補欠分子族(補酵素または金属イオン)を持ち、これが電子供与性の基質によって還元される。還元された補欠分子族が酸素分子を活性化して、酸素原子1個を基質分子に付加し、もう1個を水にする。NADPH、NADH、テトラヒドロビオプテリンおよびアスコルビン酸を電子供与体とする酵素が知られている。電子供与体は、酸素原子を付加される基質(RH)に対して、補助基質(XH2)として働く。一酸素添加酵素の反応は、次のような反応式で表される。
RH + O2 + XH2 → ROH + H2O + X (5)
テトラヒドロビオプテリンとアスコルビン酸に関しては、S. KaufmanがPharmacological Reviewの論文(1966年)(文献1)において、それぞれをフェニールアラニン水酸化酵素とドーパミンβ-水酸化酵素の補酵素と記しています。彼は、これらの酵素を純化して酵素の反応を研究した学者です。補酵素と判断した根拠は書かれていませんが、上の反応式(5)で表される酵素反応の補助基質RHとしてNADPHも知られていたからだろうと思われます。MetzlerのBiochemistryには、Coenzymesの章において、各々の補酵素について詳しい説明があります。テトラヒドロビオプテリンを水酸化酵素の補酵素として記していますが、アスコルビン酸には言及がありません。別の章のOxygenases and Hydroxylases の節ではテトラヒドロビオプテリンとアスコルビン酸を補助基質と呼んでいます。冒頭で述べたように、ドーパミンβ-水酸化酵素に関する論文のほとんどがアスコルビン酸を補因子とし、補酵素とするものは稀です。
このような背景の中で、アスコルビン酸補酵素説の妥当性を考えてみます。初めに、ドーパミンβ-水酸化酵素の反応を見ておきます。この酵素は活性部位に2個の二価銅イオンを持ち、2分子の アスコルビン酸(下の式でXH2)と1分子の酸素が下の式のように反応する。このとき2分子のアスコルビン酸は2分子のモノデヒドロアスコルビン酸(XH・)に変わる(文献2)。
RH + O2 + 2 XH2 → ROH + H2O + 2 XH・ (6)
2 XH・はXH2とXに変化するので反応式(5)と同じになる。
さて、この酵素反応におけるアスコルビン酸の作用を、上記の補酵素の属性①~④に照らして考察しましょう。①については、問題はないでしょう。しかし、②ついては、冒頭にある小城先生の質問にお答えします。文献3によると、L-アスコルビン酸のみならずイソアスコルビン酸とD-アスコルビン酸も同程度の酵素活性を与えるが、ジヒドロマレイン酸(エンジオール構造をもつ)、チオール化合物、還元型プテリジンなどではそれほどの活性がない。これは、構造特異性があるとみるべきです。また、L-アスコルビン酸に対するKmは0.6 mMであり、酵素と結合して反応すると考えられます。④の「生成物は別の反応でリサイクルされて触媒的に働く。」はどうでしょうか。この酵素は副腎髄質の細胞内のクロマフィン顆粒に局在します。顆粒内で、生成したモノデヒドロアスコルビン酸からアスコルビン酸への再生が起きるかどうかが問題です。実は、この顆粒の膜に存在するシトクロムb561が膜外のアスコルビン酸から1電子を受け取って、膜内のモノデヒドロアスコルビン酸に渡します。その結果、アスコルビン酸が再生されることが分かっています(文献4)。
ところで、アスコルビン酸を補助基質とする水酸化酵素として、ドーパミンβ-水酸化酵素のほかにペプチジルグリシン α-アミド化一酸素添加酵素があります。この酵素は、オキシトシンやバソプレシンのようなペプチドホルモンの末端にカルボキサミド(-CONH2)基を作るときに働きます。反応機構がドーパミンβ-水酸化酵素と同様であるばかりでなく、補助基質の特異性(イソアスコルビン酸がL-アスコルビン酸と同程度の活性を示すが、ほかの還元性の補酵素のNADPH やテトラヒドロビオプテリンでは活性が出ない(文献5))も、モノデヒドロアスコルビン酸の再生反応(神経ペプチド分泌小胞の膜に存在するシトクロムb561が働く(文献6))も類似しています。
以上の根拠によって、「ドーパミンβ-水酸化酵素とペプチジルグリシン α-アミド化一酸素添加酵素の反応で、アスコルビン酸は補酵素である」という結論に至りました。
参考文献
1. Kaufman S: Coenzymes and
hydroxylases: ascorbate and dopamine-beta-hydroxylase; tetrahydropteridines and
phenylalanine and tyrosine hydroxylases, Pharmacol Rev, 18, 61-69 (1966)
2. Diliberto Jr E J, Allen
PL: Mechanism of dopamine-beta-hydroxylation: Semidehydroascorbate as the
enzyme oxidation product of ascorbate, J Biol Chem, 256, 3385-3393 (1981)
3. Levin EY, Levenberg B,
Kaufman S: The enzymatic conversion of 3,4-dihydroxyphenylethylamine to
norepinephrine, J Biol Chem, 235, 2080-2086 (1960)
4. Kelley PM, Jalukar V, Njus D: Rate of electron transfer between
cytochrome b561 and extravesicular ascorbic acid, J Biol Chem, 265, 19409-19413
(1990)
5. Murthy AS, Keutmann HT, Eipper BA: Further characterization of
peptidylglycine alpha-amidating monooxygenase from bovine neurointermediate
pituitary, Mol Endocrinol, 1, 290-299 (1987)
6. Duong LT, Fleming PJ, Russell JT:An identical
cytochrome b561 is present in bovine adrenal chromaffin vesicles and posterior
pituitary neurosecretory vesicles, J Biol Chem, 259, 4885-4889, (1984)
追記
ハーパーの教科書には、「ビタミンCは2群のヒドロキシラーゼの補酵素である」との表題の下に、ビタミンC のコラーゲン水酸化酵素やドーパミンβ-水酸化酵素における役割を説明しています。しかし、コラーゲン水酸化酵素の場合、アスコルビン酸を補酵素とするのは誤りです。プロリル水酸化酵素に代表される、二価鉄とα-ケトグルタール酸を要求する二酸素添加酵素の場合は、アスコルビン酸は補因子とすべきです。アスコルビン酸は酵素の二価鉄の状態を維持するのが役割で、酵素の触媒過程の素反応には関与せず、基質であるプロリン残基の水酸化とアスコルビン酸の酸化は化学量論的に起きません。
名古屋女子大学で同僚だった佐野満昭先生から、冒頭の小城先生と同じような質問がありました。あまりにも似ていて驚きました。
「この酵素の酵素反応を行う際に、・・・・Cu2+を還元するのであれば、ビタミンC以外の還元物質で代替できるのかどうか。」
「補酵素とは、アポ酵素に結合または配位して、完全な酵素(ホロ酵素)を形成するために必要な部品を補酵素というのか、または、酵素反応が進行する際に必要な物質も補酵素とするのか。」
両先生の質問に回答できなければ、「ドーパミンβ-水酸化酵素の場合は補酵素とするのが適切」という私の主張に説得力がありません。それで、インターネットで検索しつつ孤軍奮闘した結果、この記事を完成できました。最後に、貴重なコメントを頂いた両先生に感謝いたします。
無断転載禁止